分子生命科学・機能生物化学・蛋白質分子工学
若杉 桂輔 教授(統合生命科学コース) 研究室HP
「化学的アプローチからの生命の神秘の探究」
1. はじめに
46億年前に地球が誕生し、約38億年前に生命が誕生して以来、単細胞生物から多細胞生物の出現、脊椎動物の出現、さらに、免疫系、脳神経系の発達など、生物は進化を続けています。生命現象を実際に担っている分子にタンパク質があります.タンパク質は全部で20種類のアミノ酸がペプチド結合で連なったもので遺伝情報に基づいて合成されます.一般に原始的な生物のタンパク質は機能の面でも単純で一つの機能だけを担っています.他方、高等な生物では、タンパク質にアミノ酸の置換やアミノ酸配列(付加ドメイン)の融合などが起こることにより、従来の原始的な生物の機能を維持しながらも全く別の機能を併せ持ったものもあることがわかってきました.つまり、生物の進化に伴い、タンパク質の機能も進化していることが最近わかってきました.私の研究室では、天然のタンパク質の新たな未知機能を探索したり、タンパク質を人工的に改変、創製することを目指しています.特に、物理化学、分析化学、有機化学、無機化学、生物化学などの化学を最大限に駆使し、分子生物学、細胞生物学的手法と融合させることにより、非凡な機能を有するタンパク質(従来のタンパク質の機能分類とは異なる機能を持ったタンパク質)を発見し、生物進化とともにどのようにタンパク質の機能が進化してきたのかを分子・原子レベルで解明することを目指しています.
2. 細胞外でサイトカインとして機能するアミノアシルtRNA合成酵素の発見
アミノアシルtRNA合成酵素は、全身の細胞に発現しており、細胞内でtRNAとアミノ酸からアミノアシルtRNAを合成する(アミノアシル化)反応を触媒するタンパク質(酵素)です.20種類のアミノ酸それぞれに対し特有なアミノアシルtRNA合成酵素が存在します.チロシルtRNA合成酵素
(TyrRS)はアミノ酸の一つであるチロシンのtRNAへのアミノアシル化反応を触媒する酵素です.ヒトのTyrRSは、下等な生物のTyrRSと比較し、触媒活性には不要な余分な付加ドメインをC末端側に融合していることが明らかになりました.アミノ酸配列の類似性に着目した検索(ホモロジー検索)をしたところ、このC末端付加ドメインの配列が細胞間の情報伝達物質(サイトカイン)と類似していることが明らかになりました.そこで、サイトカインとしての活性に着目して実験したところ、付加ドメインがサイトカインとして機能すること、さらに驚いたことに、触媒活性ドメイン(mini
TyrRS)にもサイトカイン活性があることを発見しました(図1).さらに、ヒトのTyrRSがアポトーシスの初期段階で細胞外に分泌され、タンパク質分解酵素(プロテアーゼ)によりmini
TyrRSと付加ドメインとに切断されること、また切断前はサイトカインとしての活性はないことも明らかになりました(図1).さらに、mini TyrRSは細胞表面にあるインターロイキン8
(IL8)リセプターに結合すること、また、IL8の場合と同様にGlu-Leu-Arg(ELR)という3つのアミノ酸からなるモチーフ配列がサイトカイン活性に重要であることが明らかになりました.
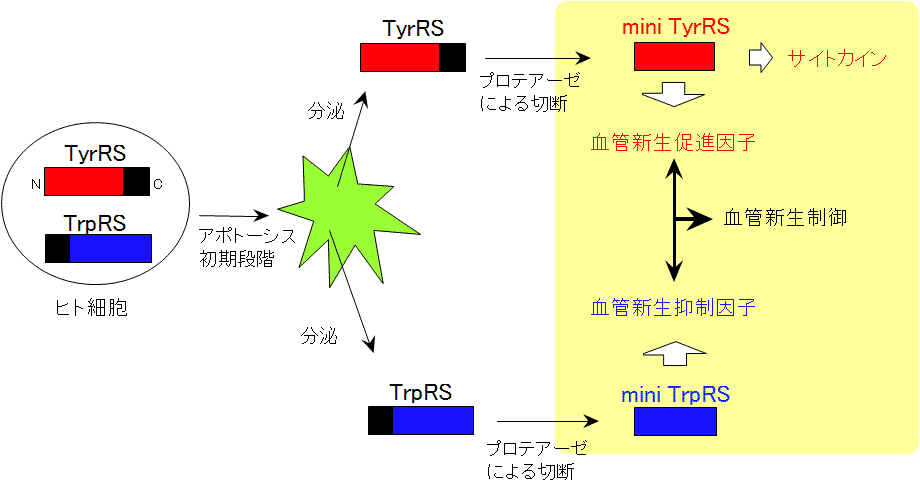
図1.チロシルtRNA合成酵素(TyrRS)とトリプトファニルtRNA合成酵素(TrpRS)の新規機能(但し、TyrRS, TrpRSの触媒活性ドメインをそれぞれ赤、青、付加ドメインを黒で示した)
3.血管新生の制御因子としての機能も併せ持つアミノアシルtRNA合成酵素の発見
トリプトファニルtRNA合成酵素 (TrpRS)は、tRNAにトリプトファンを結合させるアミノアシル化反応を触媒するタンパク質です.TrpRSは20種類のアミノアシルtRNA合成酵素の中でTyrRSと最も分子進化的に近縁の酵素であり立体構造も類似していることが明らかになっています.ヒトTrpRSは、下等な生物のTrpRSと比較し、N末端側に付加ドメインを有しており、プロテアーゼにより付加ドメインが切断され、触媒活性ドメイン(mini
TrpRS)が産生することが明らかになりました(図1).
IL8はαケモカインの一つです.ELRモチーフを持つαケモカインは血管新生を促進する因子として働き、ELR以外の配列を持つαケモカインは逆に血管新生を抑制する因子として機能することが報告されていたので、まずELRモチーフを持つmini
TyrRSの血管新生の活性について解析しました.その結果、mini TyrRSは血管新生促進因子として機能すること、他方、ELRモチーフを持たないmini
TrpRSは逆に血管新生抑制因子として働くことを発見しました(図1).ヒトTrpRSの触媒活性ドメインは、その後、糖尿病性網膜症、加齢(老人性)黄斑変性症の治療薬として臨床試験が行われており、市販の薬より優れた治療効果、しかも、副作用が極めて低い結果が得られています.
4. ヒトのニューログロビン(Ngb)の酸化ストレスに伴う細胞死を防ぐ分子機構の解明
酸化ストレスとは、反応性が非常に高い酸素ラジカル(活性酸素種)が産生されている状態のことであり、神経細胞死を引き起こします.2000年、神経細胞に特異的に発現し可逆的な酸素結合が可能なタンパク質「ニューログロビン(Ngb)」が報告され、Ngbに酸化ストレスに伴う細胞死を抑制する働きがあることが示唆されました.また、最近、Ngbにアルツハイマー病を防ぐ効果があることも報告され注目を集めています.私たちは、不明であった神経細胞死の抑制メカニズムの解明を目指すため、ホモロジー検索などを駆使し仮説をたて検証した結果、酸化ストレスにより生じる酸化型Ngbがヘテロ三量体Gタンパク質のαサブユニット(Gα)と特異的に結合し「GDP/GTP交換反応抑制タンパク質(GDI)」として機能することを明らかにしました.そして最終的には、従来グロビンタンパク質は酸素結合タンパク質としてだけ働くものと考えられてきましたが、ヒトNgbは酸化ストレス応答性のセンサータンパク質として働き、酸化ストレスを受けた時、細胞の生死をつかさどる細胞内シグナル伝達過程を制御することにより、神経細胞死を防いでいることを実証しました.
5.「細胞膜貫通特性」を持つ魚類のグロビンタンパク質の発見
Ngbを発現している脊椎動物の中で進化的にヒトから最も離れているのは魚類です.魚類のゼブラフィッシュNgbを解析するとGDIとしての活性はないことが明らかになりました.ヒトNgb及びゼブラフィッシュNgbはともに4個の構造ブロック単位「モジュール」M1~M4で構成されています.タンパク質が構造及び機能単位である「モジュール」の組み換えによって進化してきたというタンパク質の分子進化仮説に着目し、ゼブラフィッシュNgbのモジュールM1とヒトNgbのモジュールM2~M4からなる融合タンパク質であるキメラNgbを作製し、構造及び機能の解析を行いました(図2).このキメラNgbはヒトNgb同様のGDI活性を持っており、タンパク質を細胞外から細胞内へ導入できる試薬“Chariot”を用いてキメラNgbを細胞内に導入すると、細胞死を抑制することが明らかになりました(図2).
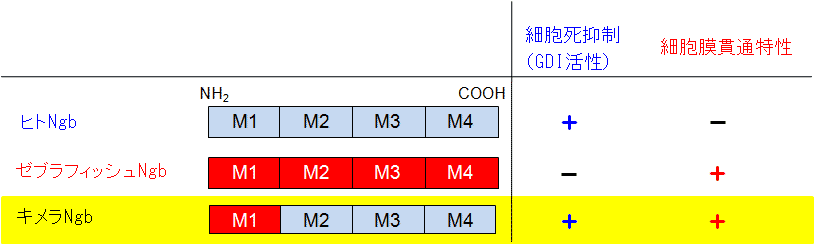
図2.天然及びキメラニューログロビン(Ngb)の特性
ある時、Chariot無しでこの実験をしたところ、驚いたことに、キメラNgbはChariotが無くても細胞死を抑制することに気が付きました.そこで、Ngbを蛍光標識し、Chariot非存在下で培地に添加して一定時間培養後、蛍光顕微鏡により観察したところ、ゼブラフィッシュNgb及びキメラNgbには細胞の外から細胞内に自ら移行する働き「細胞膜貫通特性」があることが明らかになりました(図2).ゼブラフィッシュNgbとキメラNgbはゼブラフィッシュNgb由来のモジュールM1を共通して含むことから、ゼブラフィッシュNgbのモジュールM1が細胞膜貫通特性に重要な働きをしていると考えられます.その後、部位特異的にアミノ酸を置換したタンパク質を解析することにより、ゼブラフィッシュNgbの細胞膜貫通特性にはモジュールM1内の4つの正電荷を帯びたリジン残基が重要であること、また、ゼブラフィッシュNgbは細胞表面に存在する負電荷を帯びたグリコサミノグリカンと静電的に相互作用し細胞膜貫通することを明らかにしました.
6. おわりに
タンパク質に従来知られていた機能とは全く異なる働きがあることを発見できた背景には、「掘り出し物を見つける幸運(セレンディピティー)」があったと感じます.意外な発見は隠れているものであり、注意深く物事を見て見逃さないことが重要です.偶然の出来事は、何の気なしに見逃されたり、失敗として捨ててしまいがちで、セレンディピティー的発見ができるかどうかは、待ち受けるものの心構え次第です.旺盛な好奇心、深い思考力、注意深い洞察力などが必要です.そこで、一番大きな成果を出す秘けつは自分がおもしろいと思うことをやることだと思います.自分が興味を持っていることは自ら進んで楽しんでやりますし、苦労になりません.一般に、全く新しいことは主流とは異なるところにある場合が多く、批判や逆境などに耐える必要がある時があるかもしれません.その時、興味のあることであれば跳ねのけることができます.特に、「感動する心」「豊かな感性」は、オリジナリティーのある独創的な研究を生み出す原動力になります.直感とロマンを感じながらサイエンスを楽しみたいものです.<
